Technologies de pointe
Zentiva au cœur des biosimilaires
Selon le code de la Santé Publique, un médicament biosimilaire est un médicament biologique de même composition qualitative et quantitative en substance active et de même forme pharmaceutique qu’un médicament biologique de référence, mais qui ne remplit pas les conditions pour être regardé comme une spécialité générique en raison de différences liées notamment à la variabilité de la matière première ou aux procédés de fabrication ; et nécessitant que soient produites des données précliniques et cliniques supplémentaires dans des conditions déterminées par voie règlementaire. 1
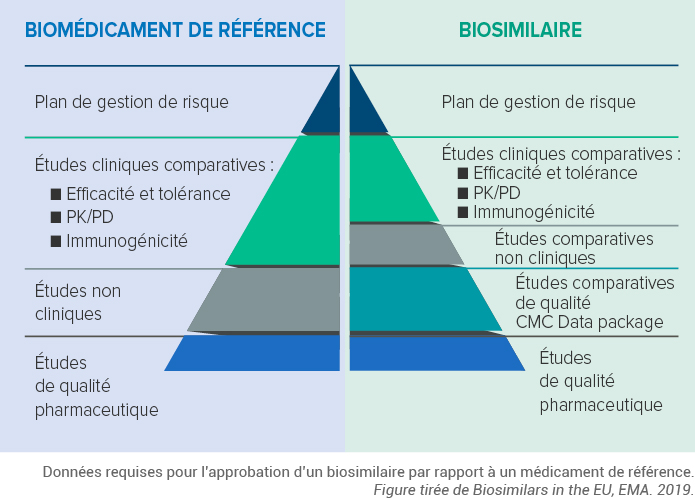
La démonstration de la biosimilarité repose sur des études comparatives entre le potentiel biosimilaire et le biomédicament de référence : le médicament biosimilaire doit être cliniquement équivalent en termes d’efficacité et d’effets indésirables à un biomédicament de référence qui a déjà une AMM et dont le brevet est passé dans le domaine public. 2,3
Zentiva innove dans les biotechnologies avec le lancement de son premier biosimilaire en partenariat avec mAbxience, une des sociétés de biotechnologie les plus innovantes au monde. Des technologies de pointe sont utilisées pour assurer la production de ces biomédicaments.
Zentiva s’engage à élargir son portefeuille de biosimilaires. Après la mise sur le marché du biosimilaire de bevacizumab en 2021, de nouveaux biosimilaires seront disponibles dès 2022. 4
Zentiva au cœur des médicaments hybrides
Selon le code de la Santé Publique, un médicament hybride est une spécialité qui ne répond pas à la définition d’une spécialité générique parce qu’elle comporte par rapport à la spécialité de référence des différences relatives aux indications thérapeutiques, au dosage, à la forme pharmaceutique ou à la voie d’administration, ou lorsque la bioéquivalence par rapport à cette spécialité de référence n’a pu être démontrée par des études de biodisponibilité. 5
À la différence des génériques dont le dossier d’AMM ne repose que sur la démonstration de la bioéquivalence par rapport à la spécialité de référence, le dossier d’AMM d’un médicament hybride, doit comporter les données démontrant :
- la qualité du médicament,
- des éléments permettant de justifier les différences présentées par rapport à la spécialité de référence,
- ou des études de biodisponibilité spécifiques. 6
- ANSM - Rapport « Etat des lieux sur les médicaments biosimilaires » - Mai 2016.
- HAS, Haute Autorité de Santé – Les médicaments biosimilaires : https://www.has-sante.fr/jcms/c_2807411/fr/les-medicaments-biosimilaires - Décembre 2017.
- Biosimilars in the EU. Information guide for healthcare professionals. EMA 2019.
- Données internes 2020.
- LOI n° 2018-1203 du 22 décembre 2018 de financement de la sécurité sociale pour 2019 (1). 2018-1203 déc 22, 2018.
- Médicaments hybrides : un registre dédié prévu au 1er janvier 2020. VIDAL. Disponible sur : https://www.vidal.fr/actualites/23991-medicaments-hybrides-un-registre-dedie-prevu-au-1er-janvier-2020.html
7100001260 - NS-ZENT-SITE ZENTIVA HOPITAL